摘要:目的 探索牛肉卤煮加工过程中添加香兰素和维生素C对杂环胺形成含量的影响。方法 采用固相萃取前处理技术,结合不同处理情况下高效液相紫外和荧光检测法测定肉样中杂环胺的含量。结果 香兰素和维生素C都能够减少卤煮牛肉中杂环胺的形成。当维生素C的添加浓度量达0.15%时, 杂环胺总量减少90%以上。当维生素C浓度增大到0.5mg/mL时, 维生素C对1,1-二苯基-2-三硝基苯(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率高达90%;当维生素C添加浓度为0.4 mg/mL时, 其对超氧阴离子的清除率高达84%左右。结论 维生素C和香兰素均可减少卤煮牛肉中杂环胺的生成, 维生素C对DPPH自由基清除率和超氧阴离子自由基清除率均比香兰素高, 且对卤煮牛肉中杂环胺的抑制效果比香兰素好。
关键词:香兰素;维生素C;卤煮牛肉;杂环胺
1 引 言
卤煮是中国肉制品传统加工方法之一, 因其能使肉制品具有松软的质感和醇香敦厚的香气所以深受大众的喜爱并一直沿用至今。但肉制品含有丰富的蛋白质, 在卤煮过程中易发生美拉德反应生成一类具有致癌作用的有机物——杂环胺。据流行病学研究报告显示, 胃肠道疾病和多种肿瘤的发生与食品中的杂环胺有着密切的关系。迄今为止人类已经在食用肉制品中发现了30多种杂环胺的存在。这30多种杂环胺可分为氨基咪唑氮芳香烃和氨基咔啉嵋2大类,其化学结构和产生机制也有所不同。氨基咪唑氮芳香烃是由肌酸/肌酐、氨基酸和还原糖在300℃以下缩合聚合形成的;而氨基咔啉嵋是氨基酸和蛋白质300℃以上的高温条件下热裂解产生的。
近30年来, 国内外对于食品中杂环胺的分离检测、安全评价、及产生机制等方面做了较为深入的研究。随着人们对于健康饮食的追求, 如何有效抑制加工肉制品中杂环胺的生成成为当前研究的热点。有研究表明自由基反应参与了杂环胺的生成, 而抗氧化剂或者含抗氧化成分的植物提取物能够清除美拉德反应中产生的吡啶和吡嗪等自由基, 从而抑制杂环胺的生成。1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基清除率和超氧阴离子自由基清除率常被用来评价人工合成或天然抗氧化剂以及一些植物提取物抗氧化性的强弱。抗氧化剂的DPPH 自由基清除率和超氧阴离子自由基清除率越大,说明其对美拉德反应中间产物的不稳定自由基清除能力就越强。
杨潇等在早期开展烟熏液替代传统烟熏加工技术研究中, 发现烟熏液及其重要组成成分具有抑制杂环胺等多种化合物的作用,这可能与烟熏液中的抗氧化成分有关。Wong等在考察B族维生素对煎炸牛肉中2中杂环胺(PhIp、MeIQx)含量变化的影响时发现VB2、VB3、VB5、VB9、VB12对这2种杂环胺的抑制效果超过40%。Cheng等在研究12种酚类化合物对牛肉中杂环胺含量的影响时发现:柚皮素、槲皮素等黄酮类化合物能够与杂环胺生成中间产物苯乙醛结合生成特定的化合物从而阻断了杂环胺的形成。合理地添加一些人工合成或者天然抗氧化剂可以有效抑制加工肉制品中杂环胺的生成,但是人工合成的抗氧化剂如丁基羟基茴香醚和二丁基羟基甲苯等具有一定的潜在毒性, 所以用天然抗氧化剂代替人工合成抗氧化剂是个理想的选择。目前二丁基羟基甲苯、白藜芦醇、维生素E、十字花科植物中的异硫氰酸盐和葱蒜中的二丙烯基二硫化物已被证明可以抑制杂环胺的形成, 但其结果经常存在分歧。关于香兰素和维生素C对肉制品卤煮过程中杂环胺的影响尚未见相关报道。
本文以牛肉为研究对象,分别添加质量分数为0.05%、0.10%、0.15%的香兰素和维生素C,研究卤煮条件下不同添加浓度对杂环胺含量的影响, 并探究不同的添加物对DPPH的清除率和超氧阴离子的清除率的影响。
2 材料与方法
2.1 材料与试剂
新鲜牛后腿肉、金龙鱼调和油、中盐特制低钠食盐、甘汁园双碳绵白糖、海天酱油、海天生抽。
浓盐酸、氢氧化钠、三氯乙酸、冰醋酸、氨水、二氯甲烷;乙腈、甲醇;香兰素、抗坏血酸。
杂环胺标品: 2-氨基-1-甲基-6-苯基-咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine, PHIP)(CAS: 92180-79-5, 分子量: 227.27);3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1-methyl-5H-pyrido[4,3-b]indole,Trp-P-2)(CAS:72254-58-1,分子量: 257.29);2-氨基-3,4,8-三甲基-3H-咪唑并[4,5-f]喹喔啉(2-amino-3,4,8-trimethyl-3H-imidazo[4,5-f]quinoxaline, 4,8-DimeIQX)(CAS: 95896-78-9, 分子量:227.27); 3-氨基-1,4-甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)(CAS:62450-06-0, 分子量: 211.26);2-氨基-3,4-二甲基-3H-咪唑并[4,5-f]喹喔啉(2-amino-3,4-dimethyl-3H-imidazo [4,5-f]quinoxaline, MeIQ)(CAS: 77094-11-2,分子量: 212.25);2- 氨基-3,8- 二甲基吲哚并[4,5-f] 喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline, MeIQX)(CAS:77500-04-0,分子量: 213.24);1- 甲基-9H- 吡啶并[3,4-b] 吲哚(1-methy-9H-pyrido[3,4-b]indole, Harman)(CAS: 244-63-3,分子量: 168.19);2- 氨基-9H- 吡啶并[3,4-b] 吲哚(2-amino-9H-pyrido[2,3-b]indole, AαC)(CAS: 26148-68-5,分子量:183.21);2-氨基-3-甲基-3H-咪唑并[4,5-f]喹喔啉(2-amino-3-methyl-3H-imidazo[4,5-f]quinoxaline, IQ)(CAS:108354-47-8, 分子量:199.21)。以上标准品纯度均大于99%。
2.2 仪器与设备
G1315A紫外检测器、G1312荧光检测器、Agilent1100高效液相色谱仪、硅藻土Bond Elut-PRS柱(500mg/3mL)、Bond Elut-C18柱(500mg/3mL);AR1140电子分析天平;BCD-249CF美菱冰箱;DGF30/7-Ⅰ型电热鼓风干燥箱;SHZ-D(Ⅲ)循环水式多用真空泵;CR15RT型台式高速冷冻离心机;T 6紫外分光广度计;ASE-12固体萃取仪;HH-2型数显恒温水浴锅;GW-4高温烘箱;ZSBN-3004全自动不锈钢双切机。
2.3 原料前处理
首先剔除原料牛肉中脂肪和筋膜, 然后用双切机制成5mm×1cm×5cm大小的肉条, 并分装成50g每份置于冰箱中备用。
卤煮:取白砂糖1g、食盐1g、酱油5mL、蒸馏水150mL 置于250mL带有刻度的加盖搪瓷缸中配成卤液并加热至沸腾(沸腾状态下卤液温度为98℃左右)。然后取肉条100g放入卤液中加盖, 在电磁炉上用小火慢炖, 进行卤制2 h,每隔30min补充1次开水(蒸馏水)至原刻度,保证最终卤液体积于起始相同。将处理后样品冷却至室温,后于-18℃下冷冻、备用。
实验组:维生素C 添加组: 取白砂糖1g、食盐1 g、酱油5mL、蒸馏水150mL 置于250mL的搪瓷缸中配成卤液并加热至沸腾(沸腾状态下卤液温度为98℃左右)。然后取50g分别添加了0.025g(0.05%)、0.05 g(0.1%)、0.075g(0.15%)维生素C的肉条置于沸腾的卤液中,加盖在电磁炉上用小火慢炖,进行卤制2h,每隔30min补充1次开水(蒸馏水)至原刻度,保证最终卤液体积与起始相同。
香兰素添加组:取白砂糖1g、食盐1g、酱油5mL、蒸馏水150mL 置于250mL的搪瓷缸中配成卤液并加热至沸腾(沸腾状态下卤液温度为98℃左右)。然后取50 g 分别添加了0.025g(0.05%)、0.05g(0.1%)、0.075g(0.15%)香兰素的肉条置于沸腾的卤液中,加盖在电磁炉上用小火慢炖,进行卤制2h,每隔30 min补充1次开水(蒸馏水)至原刻度,保证最终卤液体积与起始相同。
对照组:取白砂糖1g、食盐1g、酱油5mL、蒸馏水150mL置于250mL的搪瓷缸中配成卤液并加热至沸腾(沸腾状态下卤液温度为98℃左右)。取50g的肉条置于沸腾的卤液中,加盖在电磁炉上用小火慢炖,进行卤制2h,每隔30min补充一次开水(蒸馏水)至原刻度,保证最终卤液体积与起始相同。
空白组:取白砂糖1g、食盐1g、酱油5mL、蒸馏水150mL置于250mL的搪瓷缸中配成卤液但不加热。取50g的肉条置于卤液中,保持2h。
2.4 杂环胺检测
2.4.1 标准曲线的制作
准确称取9种单个杂环胺标准品各1mg分别溶于10mL甲醇溶液中得到100μg/mL的杂环胺标准液,依次将杂环胺标准品稀释到1、5、10、50、100ng/mL,并据此建立标准曲线。
2.4.2 杂环胺的提取
取2g处理好样品于50mL离心管中, 加入12 mL 2mol/L的NaOH溶液并均质处理成浆状,接着在4℃、10000r/min条件下冷冻离心20min。将上清液倒入事先称好含有10g硅藻土的烧杯中,搅拌均匀后加入初次洗脱管中洗脱,初次洗脱管和丙基磺酸(propyl sulfonic acid,PRS)阳离子交换柱用连接阀连接起来, PRS柱使用之前要用5mL的二氯甲烷进行活化处理。连接好固相萃取装置, 打开真空泵, 缓慢加入70mL二氯甲烷,以2滴/3s的速度洗脱。
2.4.3 高效液相色谱条件
极性杂环胺(MeIQX、MeIQ、IQ、DimeIQX)通过紫外检测器进行检测,检测波长为63 nm;非极性杂环胺(Trp-P-2、Harman、Trp-P-1、AαC)和极性杂环胺PHIP通过荧光检测器检测, 检测时激发光波长为300nm,散色光波长为440nm。
色谱柱为TSK-Gel ODS-80TM(250mm×4.6mm,5μm);柱温设定在30℃;采用双流动相,流动相A:乙腈;流动相B: 0.05 mol/L 醋酸-醋酸氨缓冲液(pH=3.6),流动相梯度洗脱顺序如表1所示。
表1 流动相梯度洗脱顺序
| 时间/min | 流动相A(乙腈) | 流动相B(醋酸-醋酸氨缓冲液) |
| 0~25 | 90% | 10% |
| 25~35 | 50% | 50% |
| 35 以后 | 90% | 10% |
2.5 DPPH 清除率的测定
准确称取1.972mg DPPH用乙醇溶液并定容与10mL容量瓶中, DPPH浓度为0.5 mmol/L, 避光保存(0~4℃);向4 mL浓度为0.1mmol/L的DPPH乙醇溶液中加入4 mL不同质量浓度(0.1、0.2、0.3、0.4、0.5mg/mL)的香兰素和维生素C溶液,混匀,暗处放置1h,在515nm波长处测定吸光度Ai。以4mL蒸馏水作空白对照,515nm波长处测定吸光度A0,以4mL蒸馏水加4mL不同浓度的样液515nm波长处测定吸光度Aj,重复3次。按下面公式计算DPPH自由基清除率。
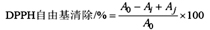
2.6 超氧阴离子清除率
取3mL 0.05mol/L Tris-HCl 缓冲液(pH=8.2),置于25℃水浴20min,分别加入同体积不同浓度的待测液(这里将待测液依次稀释至0.1、0.2、0.3、0.4、0.5mg/mL),和0.6mL30mmol/L邻苯三酚溶液, 混匀后于25℃水浴25min,加入0.5mol/L 1 mol/L HCl终止反应,于325 nm 处测吸光度A1;若考虑样品自身在325 nm处的吸光值,记吸光度为A2。空白对照组为A3。则
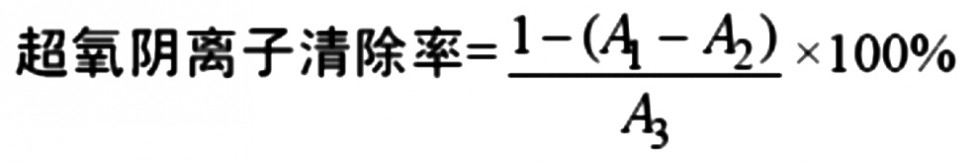
以上实验均重复3次, 取平均值。
3 结果与分析
3.1 杂环胺标准曲线
9种杂环胺的线性方程、相关系数、线性范围和检出限见表2。结果表明此方法适用于9种杂环胺的检测。
3.2 杂环胺含量的结果分析
不同浓度不同添加物对牛肉极性和非极性杂环胺含量的影响见表3、表4,添加物对杂环胺总量的影响见图1。结果表明:香兰素和维生素C的添加均可使卤煮牛肉中的杂环胺总量显著降低(P<0.05)。从上述表格数据可以看出,添加维生素C时牛肉中的极性和非极性杂环胺含量均减少。而香兰素随着浓度增大,极性杂环胺反而有所增高,可见香兰素只能降低非极性杂环胺的水平。当维生素C的添加浓度量达0.15%时,杂环胺总量减少99%。综上所述,维生素C较香兰素相比能够更好地减少卤煮牛肉中杂环胺的生成。
表2 9种杂环胺的线性范围、线性方程、相关系数和检出限
| 化合物 | 线性范围(ng/mL) | 回归方程 | 相关系数 | 检出限(ng/mL) |
| DimeIQx | 5~500 | Y=0.3095X-1.9861 | 0.9986 | 0.0028 |
| MeIQx | 5~500 | Y=0.3891X-2.1088 | 0.9987 | 0.0016 |
| IQ | 5~500 | Y=0.38X-1.8026 | 0.9991 | 0.0030 |
| Harman | 5~500 | Y=0.2645X-0.407 | 0.9998 | 0.0100 |
| Trp-P-1 | 5~500 | Y=0.2607X-1.1336 | 0.9997 | 0.0055 |
| Trp-P-2 | 5~500 | Y=0.3274X-0.9892 | 0.9996 | 0.0017 |
| AαC | 10~500 | Y=0.1863X-2.0397 | 0.9991 | 0.041 |
| PHIP | 10~500 | Y=0.13X-0.5596 | 0.9971 | 0.0055 |
| MeIQ | 10~500 | Y=0.2069X-0.4551 | 0.9995 | 0.0230 |
注: Y为峰面积;X 为质量浓度,ng/mL。
表3 不同浓度不同添加物对牛肉极性杂环胺含量的影响(ng/g, n=3)
| 名称 | IQ | DimeIQX | MeIQX | PHIP | MeIQ |
| 空白 | ND | ND | ND | 0.16±0.01e | ND |
| 对照 | 76.08±1.57a | 12.57±1.03a | 2.77±0.02a | 3.37±0.22a | 2.64±0.31a |
| 香兰0.05% | ND | 0.97±0.03e | 0.13±0.01d | 0.19±0.01e | 0.38±0.06e |
| 香兰素0.1% | 1.69±0.13b | 2.99±0.02c | 0.65±0.01c | 0.60±0.06c | 0.98±0.03d |
| 香兰0.15% | 3.71±0.15c | 4.21±0.11b | 1.18±0.02b | 1.25±0.07b | 1.40±0.17c |
| 维生C0.05% | ND | 1.81±0.05d | 0.63±0.04c
|
0.27±0.01d | 1.77±0.13b |
| 维生C0.1% | ND | 0.57±0.03e | ND | 0.16±0.01e | 1.03±0.10d |
| 维生C0.15% | ND | ND | ND | ND | 0.22±0.01e |
注: ND表示该物质未检出;同一列不同字母表示差异性显著(P﹤0.05)。
表4 不同浓度不同添加物对牛肉非极性杂环胺含量的影响(ng/g, n=3)
| 名称 | Trp-P-2 | Harman | Trp-P-1 | AαC |
| 空白 | ND | ND | ND | ND |
| 对照 | 3.71±0.03a | ND | 2.85±0.04a | 6.49±0.31a |
| 香兰素0.05% | 1.66±0.12b | ND | 1.23±0.11b | 1.67±0.02b |
| 香兰素0.1% | 0.78±0.03c | ND | ND | 0.45±0.02c |
| 香兰素0.15% | ND | ND | ND | ND |
| 维生素C0.05% | 0.57±0.02c | 2.46±0.21a | 0.32±0.02c | 1.53±0.03b |
| 维生素C0.1% | ND | 1.88±0.14b | 0.30±0.01c | 0.42±0.01c |
| 维生素C0.15% | ND | ND | 0.17±0.01d | ND |
注: ND表示该物质未检出;同一列不同字母表示差异性显著(P﹤0.05)。
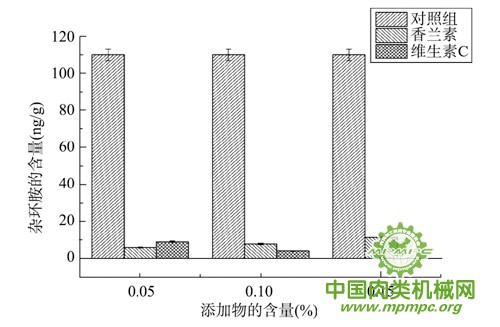
图1 添加物对杂环胺总量的影响(n=3)
3.3 DPPH 清除率结果分析
本实验过程中采用的DPPH浓度是0.8 mg/mL, 设置的外源添加物的浓度分别是0.1、0.2、0.3、0.4、0.5 mg/mL。从图2中可以看出DPPH自由基清除率总体随着添加物浓度的增加是呈明显上升趋势(P<0.05), 且维生素C的DPPH自由基清除效果明显比香兰素好,当浓度增大到0.5mg/mL时,DPPH自由基清除率高达90%左右,而香兰素的DPPH自由基清除率却只有30%左右。综上所述:维生素C较香兰素相比具有更好的DPPH自由基清除能力,同时也说明了抗氧化性与其对牛肉制品杂环胺形成的抑制具有一定的相关性。
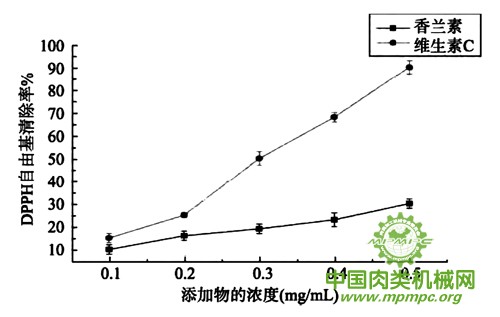
图2 DPPH清除率的测定(n=3)
3.4 超氧阴离子清除率结果分析
超氧阴离子清除率见图3, 结果显示,香兰素和维生素C均有清除超氧阴离子自由基的能力, 并且其对超氧阴离子清除率总体随着浓度增大呈明显上升趋势(P<0.05)。但是当维生素C的浓度高于0.4mg/mL时, 超氧阴离子清除率反而有所下降。当维生素C添加浓度为0.4mg/mL时,清除率达到最高,高达84%左右,而香兰素对超氧阴离子自由基的清除率最高只有40%左右,明显低于维生素C。综上所述:维生素C的超氧阴离子清除率明显高于香兰素,这也刚好说明抗氧化性与其对牛肉制品杂环胺形成的抑制具有一定的相关性。
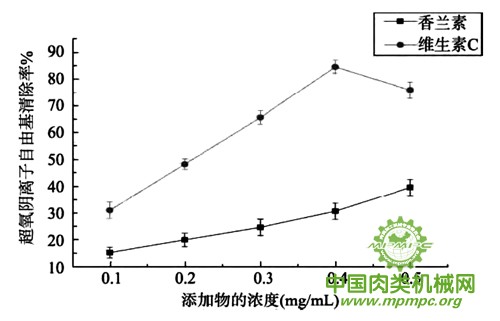
图3 超氧阴离子清除率的测定(n=3)
4 结 论
香兰素和维生素C都能够减少牛肉卤煮过程中杂环胺的形成,并且随着香兰素和维生素C的添加量的增加,杂环胺的总量呈明显降低趋势(P<0.05),当维生素C的添加浓度量达0.15%时,杂环胺总量减少90%以上。维生素C对DPPH自由基和超氧阴离子自由基的清除效果均比香兰素好;当浓度增大到0.5mg/mL时,维生素C对DPPH自由基清除率高达90%,而香兰素的DPPH 自由基清除率却只有30%左右;当维生素C添加浓度为0.4 mg/mL时,其对超氧阴离子的清除率达到最高,高达84%左右,而香兰素对超氧阴离子自由基的清除率最高只达40%左右。所以维生素C和香兰素均可减少卤煮牛肉中杂环胺的生成,而且维生素C对DPPH自由基清除率和超氧阴离子自由基清除率均比香兰素高,且对卤煮牛肉中杂环胺的抑制效果比香兰素好,这可能与其抗氧化性的强弱有关。








