摘要:研究了两种不同滚揉处理鹅肉成熟过程中的品质变化及其蛋白质构象的变化,为改善鹅肉品质提供参考。选取100日龄的浙东白鹅,随机分为三组,其中一组为对照组,另外两组分别进行滚揉10min(轻度滚揉)和滚揉30min(重度滚揉)处理。肉样置于4℃成熟,在12h、36h、72h、120h 分别取出测蒸煮损失率和剪切力值,采用拉曼光谱测定蛋白质构象。结果表明,重度滚揉鹅肉蒸煮损失率最小,轻度滚揉次之,对照组最大,均在成熟36h 达到最大值;12~120 h,对照组鹅肉剪切力值显著大于轻度滚揉(P<0.05)和重度滚揉(P<0.01)肉样,重度滚揉鹅肉剪切力值最小,嫩度最佳;成熟12 h,对照组鹅肉蛋白中α-螺旋构象含量高达80.04%,显著高于其他两组;滚揉对微环境的影响主要是影响脂肪族氨基酸的疏水相互作用,重度滚揉使脂肪族氨基酸的疏水相互作用显著增加。
浙东白鹅是浙江著名的地方特色品种,具有高蛋白、低脂肪含量、肉质细嫩等特点,是风鹅、糟鹅等传统特色鹅肉制品的主要原料,广泛养殖于浙江及周边地区,具有极重要的经济价值。据中国农业网报道,浙东白鹅一般在20~60日龄绝对增重速度最快,70日龄左右(体重3.2~4.0 kg)时上市肉质较好。然而,由于近几年禽流感事件时有发生,导致正常肉鹅出栏日龄混乱,加上羽绒拔毛的需要,大量老鹅出现在市场上。为提高鹅肉品质,我国和欧洲国家近年来主要采用姜汁浸泡、超高压、氯化钙注射、击晕、乳酸和乙酸喷淋等技术开展了一些研究。上述技术中姜汁浸泡、氯化钙注射、乳酸和乙酸喷淋容易引起肉色、风味等感官变化,二氧化碳气体击晕和超高压则设备成本较高限制其实际应用。真空滚揉曾经被普遍应用于西式火腿的前处理中,也应用于猪肉、牛肉、肉鸡和火鸡等的嫩化处理上。作为一种机械嫩化技术,滚揉的原理曾被认为是通过强机械力作用造成肌纤维断裂和肌细胞物理性损伤,引起加工、贮藏过程中肌细胞对外界作用力抵抗的下降和提高蛋白质的溶解性,进而提高肉的嫩度和保水性等。目前,滚揉技术对老龄鹅肉的嫩化效果缺乏相关研究,其对肌原纤维蛋白溶解性的促进作用机制也有待进一步深入研究。
拉曼光谱技术作为蛋白质结构分析的重要手段,近几年来拉曼光谱技术被越来越多的应用于食品分析尤其是肌肉食品蛋白质结构的分析。通过分析拉曼谱带,可以定性地分析肌原纤维一些基团和微环境的变化,定量地测定蛋白质二级结构百分含量在加工过程中的变化,从而探究蛋白质构象变化与肌肉品质变化之间的联系,为改善肉品加工和贮藏条件提供一定的理论依据。基于蛋白质结构研究新技术的特点,本研究拟选取了100日龄的浙东白鹅为原料,运用拉曼光谱技术比较了工业上常用的两种滚揉工艺(轻度滚揉和重度滚揉)对鹅肉嫩度、保水性及其蛋白质结构的影响,以期为鹅肉品质的改善和滚揉技术在鹅肉嫩化的工业应用提供理论依据,为进一步研究肌肉蛋白质结构变化对肉品品质的影响提供一些参考。
1 材料与方法
1.1 原料与设备
浙东白鹅均取自浙江宁波象山,草饲,日龄为100d左右,活体重量每只约为4 kg。
GR-20 全自动呼吸式真空滚揉机;C-LM 3B型数显式肌肉嫩度仪,东北农业大学工程学院;显微共聚焦拉曼光谱仪;XHFD 型高速分散器;电子天平。
1.2 试验方法
1.2.1 原料肉的制备
15只活鹅经宰杀放血净膛清理后迅速置于4℃冷库中冷却2 h,随机分为三组,第一组不滚揉(对照组),第二组轻度滚揉(滚揉10 min),第三组重度滚揉(滚揉30 min),每组5只鹅。滚揉条件:转速11 r/min、温度4℃、真空度75kPa。滚揉完成后,迅速将三组鹅的左右胸肉取下,按照取样点将肉样均等切分成块,进行真空包装,散开放于4℃保藏,分别成熟12 h、36 h、72 h、120 h 取出,剔除肌膜、筋腱和可见脂肪,采用拉曼光谱仪扫描蛋白结构,然后测定各项品质指标。
1.2.2 蒸煮损失率的测定
取一定大小(2.5cm×2.5cm×4cm)的肉样,称重(m1)后密封,置于85℃水浴锅中,当肉样中心温度到达75℃时保持20min。蒸煮完成后,迅速在流水中冷却到室温,用吸水纸吸干表面水分,再次称重(m2)。每组样品5个重复,按以下公式计算蒸煮损失率。
蒸煮损失率/%= (m1- m2) /m1×100
1.2.3 剪切力的测定
取测定完蒸煮损失率后的熟肉块,沿肌纤维方向钻取大小约为Φ×L=1.27×2.5cm 的肉样,置于4℃冰箱中过夜,用肌肉嫩度仪垂直肌纤维方向切断肉块,记录剪切力值(Kgf),每个肉样剪切3次,最终结果取平均值代表一个样品的嫩度。
1.2.4 蛋白质结构测定
选用785 nm 离子激光器,功率为140 mW,曝光时间10s,用20倍长聚焦镜头将激光聚焦于载玻片上的肉样,扫描1 次,获取600~1800 cm-1 范围的拉曼光谱。以苯丙氨酸的单基取代苯基环在1002cm-1 伸缩振动强度作为内标进行归一化,用Labspec 5软件对图谱进行平滑和基线校正。
1.2.5 数据分析
SAS 8.01(Statistics Analysis System,SAS,SASInstitute Inc,Cary,NC,USA,2000)用于方差分析,选用Duncan multiple range test 判断差异显著性,P<0.05。
2 结果与讨论
2.1 不同滚揉处理鹅肉成熟过程中蒸煮损失率和剪切力值的变化
鹅肉成熟过程中蒸煮损失率和剪切力值的变化分别如图1、图2所示。总体上,滚揉后鹅肉的蒸煮损失率明显小于不滚揉肉样。一方面由于滚揉机械力使鹅肉的肌纤维直径减小,使细胞更加紧密,从而减少了汁液流失,另一方面可能是滚揉对细胞的破坏作用提高了盐溶性蛋白的溶出,而这些蛋白可以结合一部分水分。可以看出(图1),成熟12 h,滚揉10 min和不滚揉肉样的蒸煮损失率分别为35.16%和34.97%,都显著大于滚揉30 min 肉样的蒸煮损失率30.39%(P<0.05),滚揉30min肉样的蒸煮损失率在12~36 h间增加,36 h时达到最大值37.23%,36~120 h内逐渐减小,到120 h减小到33.7%,此时显著小于滚揉10 min鹅肉34.91% (P<0.05)和不滚揉样品36.49% (P<0.01)。整个成熟期间,除了在36 h时蒸煮损失率与滚揉30 min鹅肉样品相等,滚揉10min 鹅肉的蒸煮损失率介于不滚揉和滚揉30 min之间,在成熟期间随时间变化不明显(P>0.05)。不滚揉鹅肉的蒸煮损失率在12h略高于滚揉10min鹅肉(P>0.05),另外三个测试时间点的蒸煮损失率值都显著大于其他两组(P<0.01)。以上结果说明滚揉可能提高肉的保水性,且重度滚揉效果优于轻度滚揉,这与Li等报道适当增加滚揉时间蒸煮损失减少的结论类似。
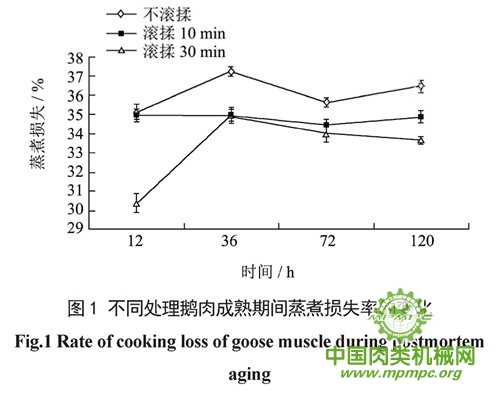
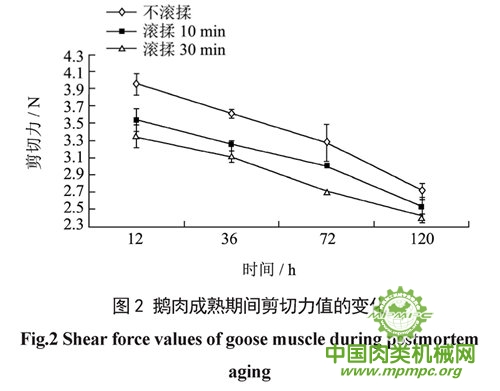
一般来说,肉质越嫩,剪切力越小,越容易被切断。由图2可以看出,各组鹅肉的剪切力随着成熟时间的增加均呈现下降趋势,并且鹅肉剪切力大小为不滚揉>滚揉10 min>滚揉30 min,这可能与鹅肉蒸煮损失率不同有关。此外,可能因为鹅肉在滚揉机内甩拍滚打过程中,肌原纤维遭到破坏甚至断裂,使肉变得松软,剪切力下降。机械外力的作用还可能加速了内源性蛋白酶的释放,使这些内源性蛋白酶可以更有效地与肌原纤维蛋白结合,促进Z线降解,进而提高肉的嫩度。Pietrasik 等发现滚揉能改变蛋白质的水化特性,这也可能是上述剪切力减小的原因。Pietrasik 等也发现延长滚揉时间能减少牛肉的蒸煮损失,减小剪切力,这与本研究中滚揉30min 鹅肉的剪切力值小于滚揉10min鹅肉的结果是类似的。
2.2 鹅肉蛋白质拉曼光谱分析
鹅肉中的主要蛋白质为肌原纤维蛋白,占肌肉总蛋白的40%~60%,它不但对肌肉的收缩起重要作用,同时也与肉品质构特性以及色泽等密切相关。Herro 等利用拉曼光谱技术对冻藏期间的鱼肉蛋白结构进行了原位检测,发现蛋白质二级结构的相互转化,尤其是α-螺旋结构和β-折叠构象的转变,可能是引起鱼肉质构特性的变化的重要原因。Beattie 等对熟牛肉进行了拉曼光谱检测,发现肉质较硬的牛肉与肉质较嫩的牛肉之间的主要差异是他们蛋白质组成上的变化。
本研究采用拉曼光谱技术对鹅肉进行原位检测,各组鹅肉不同成熟时间的拉曼光谱如图3所示,蛋白质拉曼光谱谱带的指认如表1所示。
表1 鹅肉蛋白质拉曼光谱条带的指认
| 拉曼位移/cm-1 | 峰的指认(来源) |
| 720 | C-S伸缩振动(半胱氨酸,甲硫氨酸) |
| 757 | 色氨酸残基 |
| 830/850 | 酪氨酸残基 |
| 940 | C=C伸缩振动(a-螺旋) |
| 1002 | 苯丙氨酸C-C对称伸缩呼吸环 |
| 1031 | 苯丙氨酸C-H伸缩 |
| 1230~1350 | 酰胺Ⅲ带 |
| 1340 | 色氨酸或脂肪族C-H弯曲振动 |
| 1450 | CH,CH2,CH3的弯曲振动 |
| 1550 | 色氨酸残基 |
| 1645~1700 | 酰胺Ⅰ带 |
2.2.1 酰胺I 带拉曼光谱的变化
蛋白质的二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲几种形式。范围1645~1700 cm-1 的谱带归属于酰胺I带,它主要由C=O的伸缩振动引起,此外,C-N的伸缩振动、Cα-C-N 的弯曲振动和N-H 的面内弯曲振动也对其也微弱的贡献。12 h,对照组样品的酰胺I带最大峰位置出现在1651 cm-1 处(图3a),而此时滚揉10 min 和滚揉30 min 鹅肉的最大峰位置分别偏移至1655 cm--1和1656 cm-1 处。
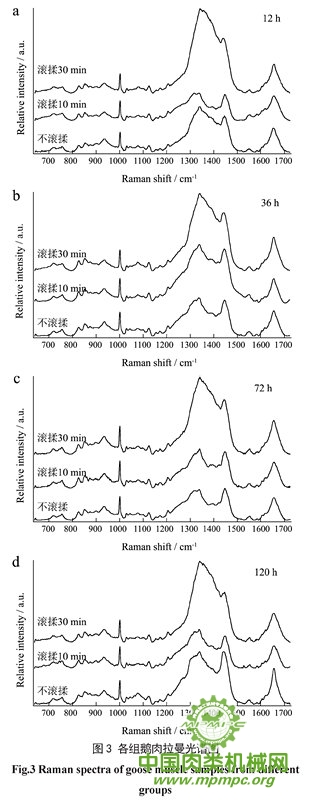
同时,从表2 中930 cm-1 的相对强度来看,12 h对照组拉曼强度(0.88)大于滚揉10 min(0.78)和滚揉30 min 鹅肉(0.79)的强度,而该处的谱峰归属于C-C 引起的α-螺旋条带,930 cm-1强度较弱表明α-螺旋结构含量较少,滚揉试验组鹅肉蛋白酰胺I 带最大峰位置向波数高的位置偏移且930 cm-1处拉曼相对强度小于不滚揉组,说明滚揉可能是引起α-螺旋结构变化的重要原因。原因可能是滚揉破坏了维持α-螺旋结构稳定的氢键,α-螺旋结构遭到破坏或向其他构象转化。Schmidt等研究羊肉拉曼光谱信息与其剪切力的关系,测得肉质硬的羊肉与肉质嫩的羊肉相比,由α-螺旋构象引起的拉曼信号更强,这与本试验中各组在成熟12 h时剪切力越大的鹅肉其由α-螺旋构象引起的拉曼信号越强的结果一致。在此后的成熟期间(图3b~d),各组酰胺I 带最大峰的拉曼位移都出现不规律的偏移,930 cm-1的相对强度也表现出不同程度的波动(见表2),这可能是蛋白质在储藏过程发生了不同程度的降解和重组。
2.2.2 蛋白质二级结构的定量分析
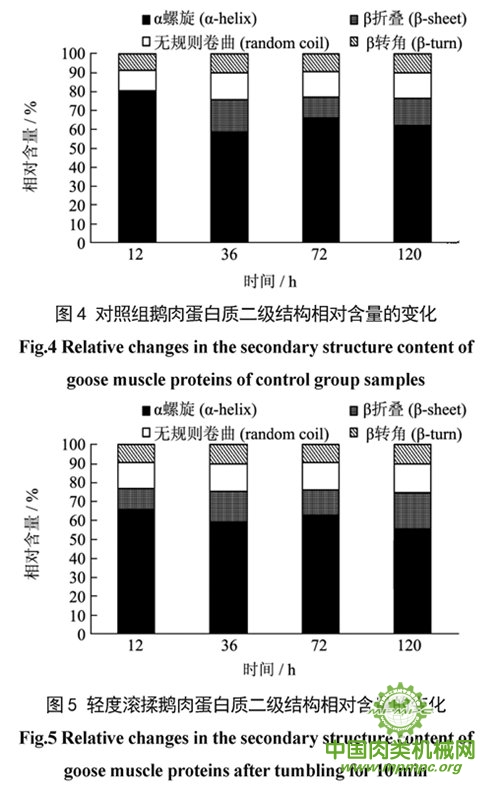
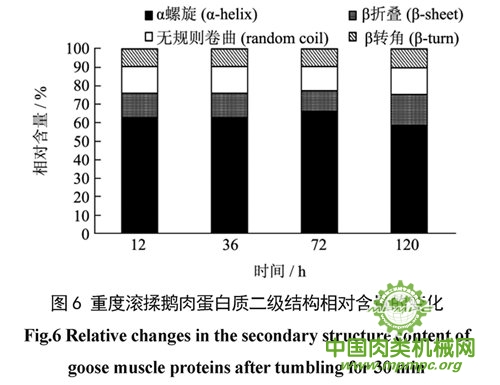
参照Alix的方法计算了蛋白质二级结构几种构象的含量,结果如图4~6 所示。如图4,不滚揉鹅肉α-螺旋结构含量在12h高达80.48%,而此时β-折叠构象含量几乎为零;12~36 h期间,该组鹅肉蛋白α-螺旋结构含量减少21.13%,而β-折叠、无规则卷曲结构含量分别增加16.4%和3.39%。由此可推断,在12~36h内不滚揉鹅肉蛋白α-螺旋结构主要向β-折叠和无规则卷曲发生了转化;到72 h,α 螺旋结构含量比36 h 增加7.06%,说明部分α-螺旋结构重新生成。滚揉10 min鹅肉在12 h 时α-螺旋结构含量为66.18%(图5),显著小于不滚揉鹅肉(P<0.01);12~72 h 内,α-螺旋结构含量先减小后又增加,说明了α-螺旋结构在鹅肉成熟过程中伸展和重新生成,可能是鹅肉肌原纤维蛋白在成熟过程中发生了重组所致。成熟12 h,三组鹅肉中滚揉30 min 鹅肉中肌原纤维蛋白质α-螺旋结构含量最少,为62.6%;12~36 h无变化,72 h增加到65.97%,120 h 又减少至58.91%;同时,β-折叠结构在76 h 减少到11.02%,120 h 又增加到16.51%(图6),表明α-螺旋主要向β-折叠结构发生转化。这些变化与酰胺I带最大峰偏移的结果相吻合。
2.2.3 蛋白质微环境的变化
1340 cm-1和1450 cm-1附近谱带的变化主要归因于脂肪族氨基酸微环境的变化,对疏水相互作用非常敏感。如图3和表2所示,12 h,滚揉10 min的鹅肉在1340 cm-1和1450 cm-1处的相对强度显著小于不滚揉组(P<0.05),而此时滚揉30 min 鹅肉在1340 cm-1和1450cm-1处的拉曼相对强度显著大于不滚揉(P<0.05)和滚揉10 min(P<0.01)鹅肉;在整个成熟期间,滚揉30 min鹅肉在1340 cm-1和1450 cm-1处的拉曼相对强度始终保持较高的水平,大于其他两组。这一结果表明,不同的滚揉处理对脂肪族氨基酸周围微环境的影响存在较大的差异,重度滚揉工艺使鹅肉脂肪族氨基酸疏水相互作用明显加强。
芳香族氨基酸侧链的一些谱带也可以反映蛋微环境的变化,例如,当色氨酸残基从包埋的疏水环境中暴露在极性环境时,760 cm-1附近的谱带相对强度减小。图3中鹅肉蛋白757 cm-1处的拉曼光谱归因于色氨酸残基,从表2可以看出,不滚揉鹅肉757 cm-1 相对强度在12~72 h 内逐渐减小,表明色氨酸逐渐暴露,而两组滚揉样品在757 cm-1处的相对强度逐渐增大,可能是滚揉后鹅肉疏水残基暴露引起。
830 和850 cm-1附近的酪氨酸残基引起的双峰是观测酪氨酸周围微环境的很好的探针。由表2可见,各组的I850/I830 值均在1.0~1.1之间波动,表明酪氨酸暴露在极性环境中或同时作为受体和中到弱的氢键供体。总体来说,不同处理间该位置拉曼强度差异不明显。
表2 各组鹅肉蛋白拉曼光谱归一化后相对强度的变化
| 拉曼位移/cm-1 | 处理方法 | 成熟时间/h | |||
| 12 | 36 | 72 | 120 | ||
| Ⅰ757 | 不滚揉 | 0.80±0.10a | 0.70±0.03a | 0.66±0.01b | 0.69±0.01b |
| 滚揉10min | 0.66±0.01b | 0.67±0.05a | 0.70±0.02a | 0.75±0.03a | |
| 滚揉30min | 0.67±0.02b | 0.69±0.08a | 0.70±0.03a | 0.76±0.01a | |
| Ⅰ850/Ⅰ830 | 不滚揉 | 1.03±0.02a | 1.06±0.04a | 1.05±0.02a | 1.06±0.03a |
| 滚揉10min | 1.04±0.02a | 1.06±0.01a | 1.04±0.02a | 1.03±0.02a | |
| 滚揉30min | 1.05±0.02a | 1.05±0.02a | 1.04±0.01a | 1.04±0.01a | |
| Ⅰ930 | 不滚揉 | 0.88±0.04a | 0.79±0.01a | 0.78±0.05b | 0.80±0.04a |
| 滚揉10min | 0.78±0.04b | 0.79±0.01a | 0.80±0.01b | 0.86±0.06a | |
| 滚揉30min | 0.79±0.04b | 0.77±0.02a | 0.82±0.01a | 0.84±0.01a | |
| Ⅰ1340 | 不滚揉 | 1.60±0.18b | 1.28±0.10c | 1.09±0.05b | 1.67±0.04b |
| 滚揉10min | 1.15±0.04c | 1.48±0.03b | 1.20±0.03b | 1.24±0.06c | |
| 滚揉30min | 3.01±0.21a | 2.43±0.08a | 2.16±0.21a | 2.40±0.13a | |
| Ⅰ1450 | 不滚揉 | 1.54±0.17b | 1.27±0.05c | 1.10±0.02b | 1.70±0.10b |
| 滚揉10min | 1.14±0.03c | 1.46±0.03b | 1.17±0.02b | 1.19±0.06c | |
| 滚揉30min | 2.75±0.08a | 2.27±0.10a | 2.01±0.08a | 2.17±0.10a | |
注:所有数据表示为平均值±标准差,n=3。同列中标注不同角标者具有显著性差异(P<0.05)。
3 结论
轻度滚揉和重度滚揉均可改善鹅肉的嫩度。重度滚揉(滚揉30 min)比轻度滚揉(滚揉10 min)鹅肉蒸煮损失率小,剪切力小,肉质更嫩。鹅肉嫩度的变化可能与蛋白质二级结构α-螺旋和β-折叠以及无规则卷曲结构的转变有关,但β-转角构象在整个试验过程中变化不明显。滚揉可能破坏α-螺旋结构或促使它向其他结构转化;不滚揉鹅肉中α-螺旋含量最高,随滚揉强度的增加,α-螺旋结构减少,β-折叠含量增加。滚揉对微环境的影响主要是影响脂肪族氨基酸的疏水相互作用,重度滚揉鹅肉蛋白脂肪族氨基酸的疏水相互作用显著增加。








